식약처, 행정예고...'신약'에서 '동등성생물의약품' 확장
'바이오혁신 토론회' 후속 조치…고역량 심사관 채용, 전담팀 투입 골자

식품의약품안전처(처장 오유경)는 11일 동등생물의약품(바이오시밀러)의 품목허가 수수료 개편을 주요 내용으로 하는 '의약품 등의 허가 등에 관한 수수료 규정' 일부개정안을 행정 예고했다.
식약처에 따르면 이번 행정예고는 9월 5일 진행한 부처합동 바이오 혁신 토론회 후속조치 중 하나로, 신약 수수료 개편 등 허가 혁신방안을 동등생물의약품 허가에까지 적용하여 허가기간을 줄이기 위한 것이다.
개정안에 따르면 동등생물의약품의 품목허가 수수료가 3억 1000만원으로 재산정된다.
식약처는 이에 따른 재원을 전담심사팀 운영, 의․약사 등 역량 높은 심사자 채용에 활용하고 심사역량 강화를 통해 동등생물의약품 허가기간을 기존 406일에서 295일까지 줄인다는 계획이다.
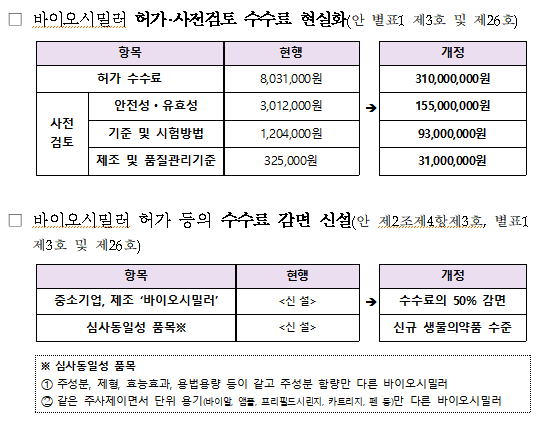
다만 업계의 부담 완화를 위해 중소기업이 국내 개발한 동등생물의약품을 허가 신청한 경우에 수수료의 50%를 감면할 예정이다.
동일 신청인이 유사한 허가를 신청(주성분 동일, 함량만 다른 제품)한 경우에도 두 번째 품목부터 8백만원(전자민원 기준)으로 수수료가 감면된다.
식약처 관계자는 "지난해 신약 허가 수수료 현실화에 이어 이번 동등생물의약품의 수수료 재산정을 통해 최근 급성장하는 바이오의약품에 대한 지원체계를 강화해 해외 시장 진출을 앞당길 수 있을 것으로 기대한다"고 밝혔다.
개정안은 식약처 누리집에서 확인할 수 있다. 개정안 관련 의견이 있는 경우 2025년 11월 11일까지 식약처에 제출 가능하다.
관련기사
- '신약 허가 혁신 방안' 시행 8개월… "심사관 31명 늘어"
- 4억원대 허가심사 수수료, 제약업계에 '양날의 검 효과'
- '심사료 4억' 받은 식약처 '첫 신약허가 신청품목에 풀 서비스'
- "희귀약 · 함량별 허가 수수료 감경 검토가능... 논의 후 결정"
- "허가 수수료 인상 알겠는데, 희귀질환 약 제외 + 유예기간 필요"
- 바이오 혁신 토론회, 어떤 논의 오갔나…업계는 분쟁·법정관리로 소란
- 신약이어 바이오시밀러도 수수료 인상... "핵심은 허가 속도 단축"
- 허가심사료 3억원 예고한 식약처 "바이오시밀러 전담팀 구축"
- 식약처, 바이오의약품 CDMO 지원 제도화 마련
- 식약처 신약허가 240일 단축… 업계 "동시병렬 심사 할 수 있나"
- 시밀러 시장 흔드는 가격 전략…셀트리온·삼성바이오 '저가 승부수'
최선재 기자
ysj@hitnews.co.kr
'사람'과 '현장'을 사랑하고, 맛있게 그리고 창조적으로 취재하고 기사를 쓰는 성실한 최기자가 되겠습니다.

